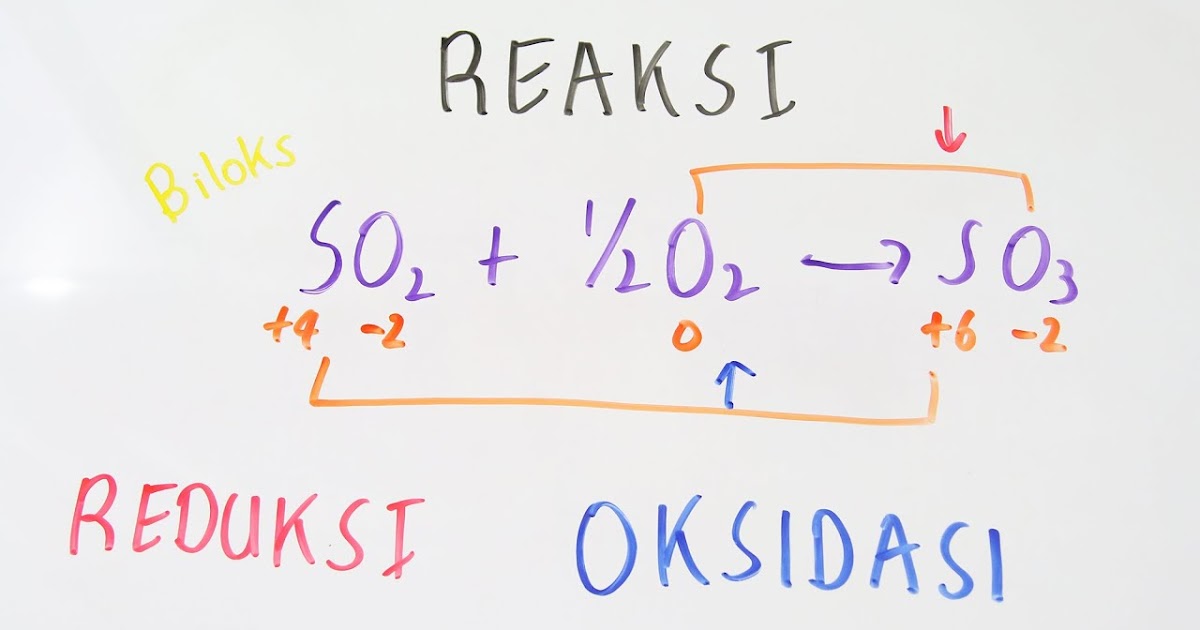
Cara Menentukan Bilangan Oksidasi Dari Unsur Yang Terdapat Di Dalam Senyawa Ion Pejuangtoga
Lihat pula: bilangan oksidasi dalam {{kotak info unsur}} Bilangan oksidasi juga dipelihara dalam artikel suatu unsur (tentu saja), dan secara sistematis dalam tabel {{Kotak info unsur/symbol-to-oxidation-state}} Pemeliharaan & peningkatan. Untuk pemeliharaan: kedua daftar dibandingkan dalam /datacheck ini, untuk mendapatkan perbaikan bersama.

Cara Menentukan Bilangan Oksidasi Matob
Pembahasan. Mn merupakan logam golongan transisi. Logam golongan transisi dapat memiliki lebih dari 1 bilangan oksidasi. Bilangan oksidasi Mn tertinggi dapat diketahui dengan menghitung bilangan oksidasi Mn pada tiap pilihan jawaban, yaitu: a. Biloks Mn dalam. b. Biloks Mn dalam. c. Biloks Mn dalam.

Bilangan Oksidasi Mn Tertinggi Terdapat Dalam Senyawa Judul Soal
3. Bilangan oksidasi atom Cr yang sama dengan bilangan oksidasi atom Mn yang terdapat pada senyawa MnO₂ adalah 4. Bilangan oksidasi Ba pada bilangan Ba₂0₂ adalah 5. Bilangan oksidasi dari H₂O adalah 6. Bilangan oksidasi dari Ag₂O adalah 7. Bilangan oksidasi dari Mn³⁺ adalah 8. Bilangan oksidasi dari H₂SO₄ 9.

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Bilangan oksidasi Mn ter.

Bilangan Oksidasi Mn Tertinggi Terdapat Pada sisi tegak pada bangun segitiga
Sifat Kimia. 1. Mempunyai berbagai macam bilangan oksidasi. Unsur transisi memiliki elektron pada orbital d. Energi tiap elektron yang terdapat dalam orbital d hampir setara. Untuk mencapai kestabilan, unsur-unsur ini membentuk ion dengan cara melepaskan elektron dalam jumlah yang berbeda. Oleh karena itu unsur-unsur ini dapat mempunyai 2 macam.

Bilangan Oksidasi Mn Tertinggi Terdapat Dalam Senyawa Judul Soal
Bilangan Oksidasi Unsur dalam Senyawa atau Ion. Bilangan oksidasi Mn tertinggi terdapat pada senyawa..a. MnO2 d. K2 MnO4 b. KMnO4 e. MnSO4 c. KMnSO4. Bilangan Oksidasi Unsur dalam Senyawa atau Ion. Reaksi Reduksi dan Oksidasi serta Tata Nama Senyawa. Kimia Fisik dan Analisis.

Cara Menentukan Bilangan Oksidasi Suatu Unsur Dalam Senyawa 5NChemistry
Solusi ngerjain latihan soal Kimia kelas 10 materi Bilangan Oksidasi Unsur dalam Senyawa atau Ion. Bilangan oksidasi Mn yang tertinggi terdapat dalam senyawa..a) K2 MnO4 b) MnO2 c) KMnO4 d) Mn2 O3 e) Mn(OH)2. MN + 2 X min 2 sama dengan nol maka biloks MN = + 4 selanjutnya kita ke soal yang ada pada soal D dia mirip mirip dengan soal B.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Biloks Mn dalam. Atom Mn dan S memiliki lebih dari satu biloks, maka kita harus lakukan ionisasi terlebih dahulu. Berikut ini adalah reaksi ionisasi dari. Setelah di ionisasi, maka akan terlihat bahwa terbentuk ion monoatomic Mn2+ yang memiliki biloks sesuai dengan muatannya, oleh karena itu, biloks Mn = +2.

Bilangan Oksidasi Tertinggi Dari Atom Ci Terdapat Pada Senyawa Lengkap
Diantara senyawa senyawa mangan berikut yang mempunyai bilangan oksidasi tertinggi adalah KMnO₄ (B) dengan bilangan oksidasi Mn = +7. Pembahasan : A. Biloks Mn dalam MnO₂ . biloks O = -2. aturan biloks : Bilangan oksidasi dalam senyawa O adalah -2 kecuali dalam peroksida (-1) dan dalam senyawa biner dengan fluor (+2).

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
Jumlah bilangan oksidasi unsur O pada molekul unsur O 2 adalah 0. Jumlah bilangan oksidasi unsur O pada senyawa biner dengan F adalah +2. Jumlah bilangan oksidasi unsur O pada senyawa peroksidasi adalah -1. Jumlah bilangan oksidasi unsur O pada senyawa superoksida adalah -½.

Bilangan Oksidasi Tertinggi Unsur O Terdapat Dalam Senyawa Blog Yuri
IA = +1, gol IIA = +2 Biloks unsur H dalam senyawa = +1, kecuali senyawa hidrida = -1 Biloks unsur O dalam senyawa = -2, kecuali peroksida = -1, dan superoksida = -½ Berdasarkan aturan tersebut, biloks N dalam masing-masing senyawa dapat ditentukan sebagai berikut. Senyawa dengan biloks N terendah adalah , yaitu -3.

Bilangan oksidasi Mn tertinggi terdapat pada senyawa....
Pada ion OH-, bilangan oksidasi O ditambah dengan bilangan oksidasi H = -1. Pada ion SO42-, bilangan oksidasi S ditambah dengan 4 kali bilangan oksidasi O = -2. Pada ion NH+4, bilangan oksidasi N ditambah dengan 4 kali bilangan oksidasi H = +1. 5. Bilangan oksidasi unsur-unsur golongan alkali (IA) dalam berbagai senyawa yang dibentuknya adalah +1

tuliskan bilangan oksidasi dari unsur besi dan mangan dari senyawa besi2 sulfat dan mangan 3
Mn 1,75 Fe 1,80 Co 1,84 Ni 1,88 Cu 1,85 Zn 1,588 Ga 1,756 Ge 1,994 As 2,211 Se 2,424 Br 2,685 Kr. Unsur dengan beberapa keadaan oksidasi Sebagian besar unsur memiliki lebih dari satu kemungkinan bilangan oksidasi.. Kolom bilangan oksidasi 0 hanya menunjukkan unsur-unsur yang diketahui berada pada bilangan oksidasi 0 dalam senyawa.

Bilangan Oksidasi atom N= 3 terdapat pada senyawa YouTube
Bilangan oksidasi unsur H pada H 2 O, HCl, H 2 S, dan NH 3 ialah +1. Bilangan oksidasi unsur H pada NaH, CaH 2, dan AlH 3 ialah -1. 6. Bilangan oksidasi unsur O pada senyawanya ialah -2, kecuali :', yaitu: 1. Pada senyawa biner dengan F, bilangan oksidasinya ialah +2. 2. Pada senyawa peroksida, seperti H 2 O 2, Na 2 O 2 dan BaO 2 , bilangan.

Bilangan Oksidasi Tertinggi Dari Atom Ci Terdapat Pada Senyawa Lengkap
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Bilangan Oksidasi Mn Tertinggi Terdapat Dalam Senyawa Judul Soal
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1