
Titik didih air lebih rendah dibandingkan titik didih int...
Karena pelarut air mendidih pada suhu 100 ∘C dan kenaikan titik didih larutan 0,3 ∘C, maka titik didih larutan H2SO4 adalah 100,3 ∘C. Sedangkan penurunan titik beku dapat dihitung melalui persamaan berikut: Tf = m ×K f × i Tf = 0,2×1,86 ×2,8 Tf = 1,0416 ∘C ≈ 1,04 ∘C. Karena pelarut air membeku pada suhu 0 ∘C dan penurunan.

H2SO4 Molecular Geometry / Shape and Bond Angles YouTube
Asam sulfat, H. 2 SO. 4, merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Produksi dunia asam sulfat pada tahun 2001 adalah 165 juta ton, dengan nilai perdagangan seharga US$8 juta.

Perhatikan tabel data titik leleh dan titik didih beberap...
Sebanyak 1 mol H2SO4 dilarutkan dalam 1.000 gram air. Jik. Kimia. Kimia Fisik dan Analisis Kelas 12 SMA. Sifat Koligatif Larutan. Kenaikan Titik Didih. Sebanyak 1 mol H2SO4 dilarutkan dalam 1.000 gram air. Jika Kb air = 0,52 C/m dan terurai sempurna, titik didih larutan tersebut adalah. Kenaikan Titik Didih.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Titik didih adalah suhu di mana tekanan uap suatu zat sama dengan tekanan atmosfer di sekitarnya. Titik didih dipengaruhi oleh faktor-faktor seperti konsentrasi, tekanan, dan ikatan antarmolekul. Artikel ini menjelaskan konsep titik didih secara ilmiah dan memberikan contoh-contoh titik didih beberapa senyawa kimia.

hitunglah titik beku dan titik didih larutan H2SO4 0,2 m jika diketahui H2SO yang terurai =0,50
A. Perbedaan dari titi didih, mendidih dan titik didih normal Titik didih adalah suhu (temperatur) dimana tekanan uap sebuah zat cair sama dengan tekanan external yang dialami oleh cairan. Titik didih suatu zat adalah suhu yang tekanan uap jenuhnya. HCl → H+ + Cl-, jumlah n = 2 H2SO4 → 2 H+ + SO42-, jumlah n = 3 H3PO4 → 3 H+ + PO43.

Urutan Titik Didih Senyawa YouTube
Asam sulfat (H2SO4) merupakan asam mineral (anorganik) yang kuat yang mana ia berbentuk cairan yang bersifat korosif, tidak berwarna tidak berbau, sangat reaktif, dan mampu melarutkan berbagai logam. Bahan kimia ini dapat larut dengan air dengan segala perbandingan, mempunyai titik lebur 10,31°C dan titik didih pada 336,85°C tergantung.

H2SO4 Lewis Structure, Molecular Geometry, and Hybridization Techiescientist
Tb = 100 + 0,6656 = 100,6656 °C. Contoh soal 6 (UN 2019) Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut. Contoh soal 6. Jika Mr NaCl = 58,5 dan Mr glukosa = 180 dan Tb air = 100 C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah…. A. 0,52 °C/m.

Cara menentukan titik didih paling tinggi Amenoma
Tb pelarut murni = titik didih pelarut (misal air : 100° C) ∆Tb = kenaikan titik didih. Sebuah larutan mempunyai titik didih yang lebih tinggi dibandingkan dengan titik didih pelarut murninya. Hal itu disebabkan karena larutan harus mencapai suhu di mana pelarut murni yang mendidih (misal air 100° C) juga harus melampaui titik didih zat.
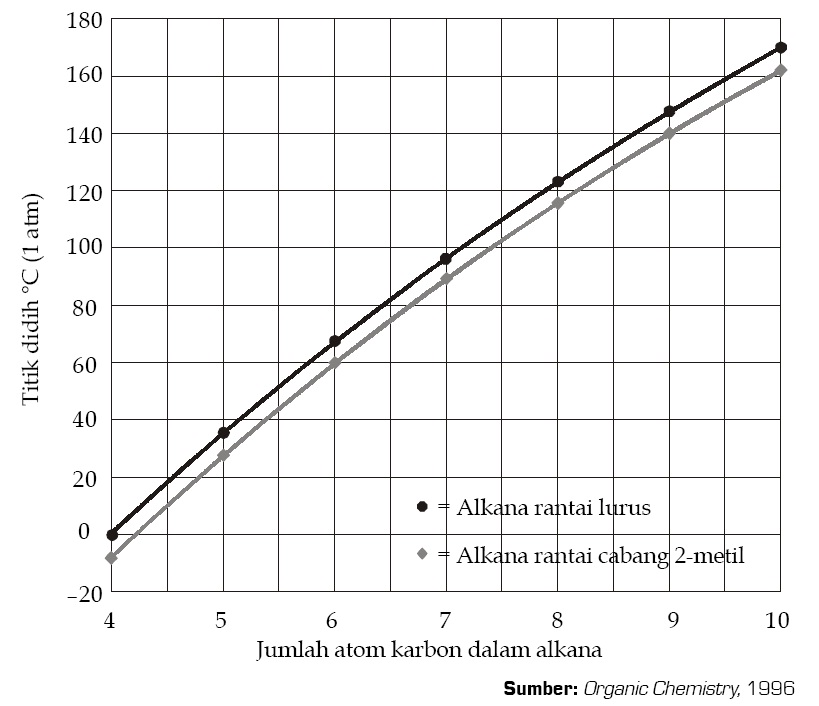
Pintar Pelajaran Titik Didih Dan Keisomeran Senyawa Hidrokarbon, Alkana, Alkena, Dan Alkuna
Titik cair: Informasi tidak tersedia Gravitasi yang digunakan 1.84 Titik Didih: Informasi tidak tersedia Persentase Penguapan: Informasi tidak tersedia Tekanan uap: 1mm Hg @ 145.8°C Tingkat Penguapan: <1 Kepadatan Uap: <0.3 @ 25°C Standar Penguapan: Kelarutan dalam Air: Dapat Larut Temperatur menyala otomatis: Tidak ada Bentuk dan bau: Cairan.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.

Larutan NH4OH 0,1 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4, Mas Soal
Titik didih: 290 °C Titik lebur: 10.4 °C pH: <1> Berat jenis: 1,84 Kepadatan uap: 3.38 BAGIAN 10 - STABILITAS DAN REAKTIFITAS Hindari kontak dengan basa kuat, bahan organik, logam bubuk halus, peroksida, karbonat, klorat, nitrat, dan zat pereduksi. Bereaksi hebat dengan air. Selalu tambahkan asam ke dalam air, jangan sebaliknya.
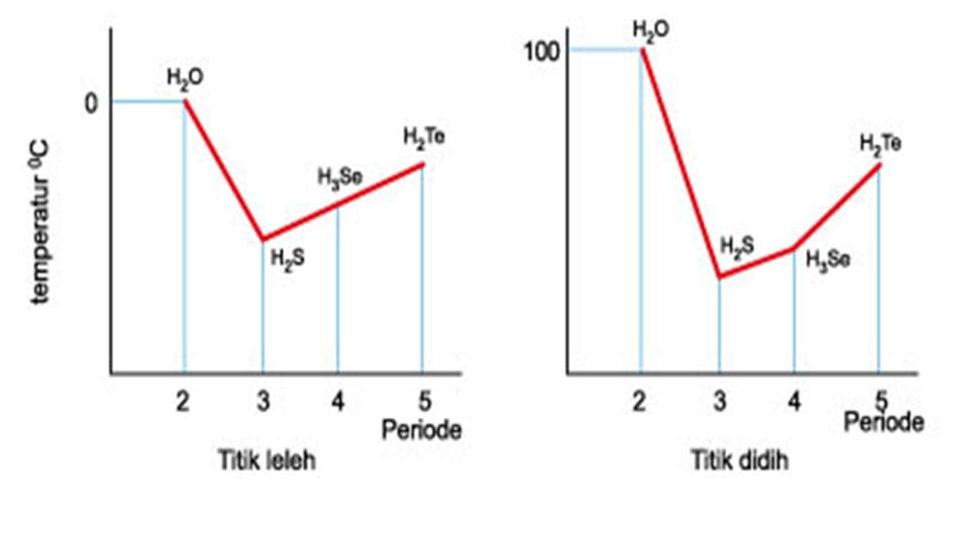
chemical engineering ikatan hidrogen
Hidrogen sulfida, H 2 S, adalah gas yang tidak berwarna, beracun, mudah terbakar dan berbau seperti telur busuk. Gas ini dapat timbul dari aktivitas biologis ketika bakteri mengurai bahan organik dalam keadaan tanpa oksigen ( aktivitas anaerobik ), seperti di rawa, dan saluran pembuangan kotoran. Gas ini juga muncul pada gas yang timbul dari.
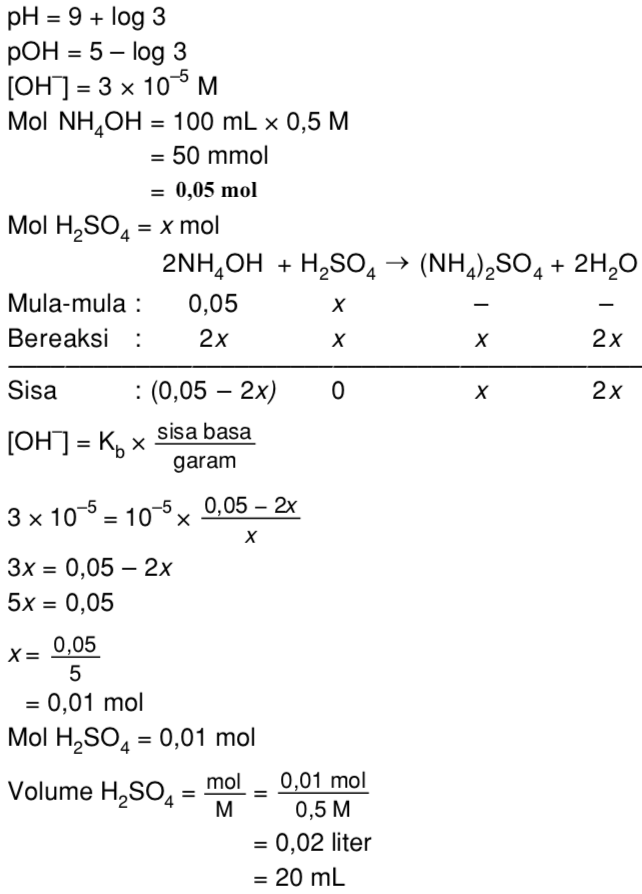
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Kenaikan Titik Didih. Larutan NaCl, KCl, MgSO4, K2SO4, dan H2SO4 masing-masing 0,1 m mempunyai faktor van't Hoff berturut-turut 1, 87; 1,86 ; 1,42 ; 2,46 ; dan 2,22. Larutan yang mempunyai titik didih tertinggi adalah.. Kenaikan Titik Didih. Sifat Koligatif Larutan.

Pengaruh Ikatan Hidrogen terhadap Titik Didih YouTube
Pada konsentrasi 98%, titik didih H2SO4 adalah sekitar 338 derajat Celsius, sedangkan titik beku dari asam sulfat berada pada suhu -10 derajat Celsius. Kelarutan. H2SO4 sangat larut dalam air, namun jika konsentrasinya sangat tinggi, maka proses pelarutan akan sangat lambat. Asam sulfat juga larut dalam pelarut organik seperti etanol, aseton.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
H2SO4 adalah cairan kental tidak berwarna atau agak kuning dengan bau menyengat. Asam sulfat memiliki kepadatan 1,84 g / mL, titik didih 337 ° C, dan titik leleh 10 ° C. Asam sulfat "pekat" adalah 98% dalam air, dan merupakan bentuk yang paling stabil. Banyak konsentrasi lain, dengan nama berbeda, tersedia untuk berbagai keperluan.

Melihat Proses Kenaikan Titik Didih Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun! Blog
Asam Sulfat memiliki titik lebur 10,31 derajat celcius dan titik didih pada 336,85 derajat celcius. Umumnya Asam sulfat dapat diproduksi dari belerang (S), pyrite (FeS), dan juga beberapa sulfida logam (Cu S, ZnS, NiS). Rumus kimia asam sulfat adalah H2SO4 terbentuk dari beberapa komponen, seperti kation asam (H+) dan anion sulfat (SO42-).