Jelaskan tentang konfigurasi elektron beserta cont...
Dari tabel di atas dapat kita ketahui bahwa elektron valensi dari Lithitum (3 Li) adalah 1 dan elektron valensi dari Sulfur (16 S) adalah 6. B. Aturan dalam Konfigurasi Elektron.. Unsur Konfigurasi Elektron Penyingkatan; 7 N: 1s 2 2s 2 2p 3 [He] 2s 2 2p 3: 12 Mg: 1s 2 2s 2 2p 6 3s 2 [Ne] 3s 2: 35 Br: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Teori Atom Bohr. Lintasan-lintasan elektron disebut juga dengan kulit elektron, yang ditempati oleh jumlah elektron maksimal. Dalam teori ini, konfigurasi elektron adalah pengisian elektron yang dimulai dari tingkat energi (kulit) paling rendah, yaitu kulit yang pertama kulit K, setelah kulit K sudah terisi penuh, dilanjutkan ke kulit L, kulit M, kulit N, hingga seterusnya.

Konfigurasi elektron dari unsur X dalam orbital adalah se...
Konfigurasi elektron adalah susunan elektron berdasarkan kulit atau orbital dari suatu atom. Jadi ada dua cara menyatakan konfigurasi elektron nih . Namun konfigurasi elektron berdasarkan orbital atom itu, lebih berguna untuk mempelajari sifat-sifat suatu zat kimia, termasuk mengapa ada zat kimia yang berwarna-warni.

Diketahui konfigurasi elektron atom unsur X dan Y sebagai...
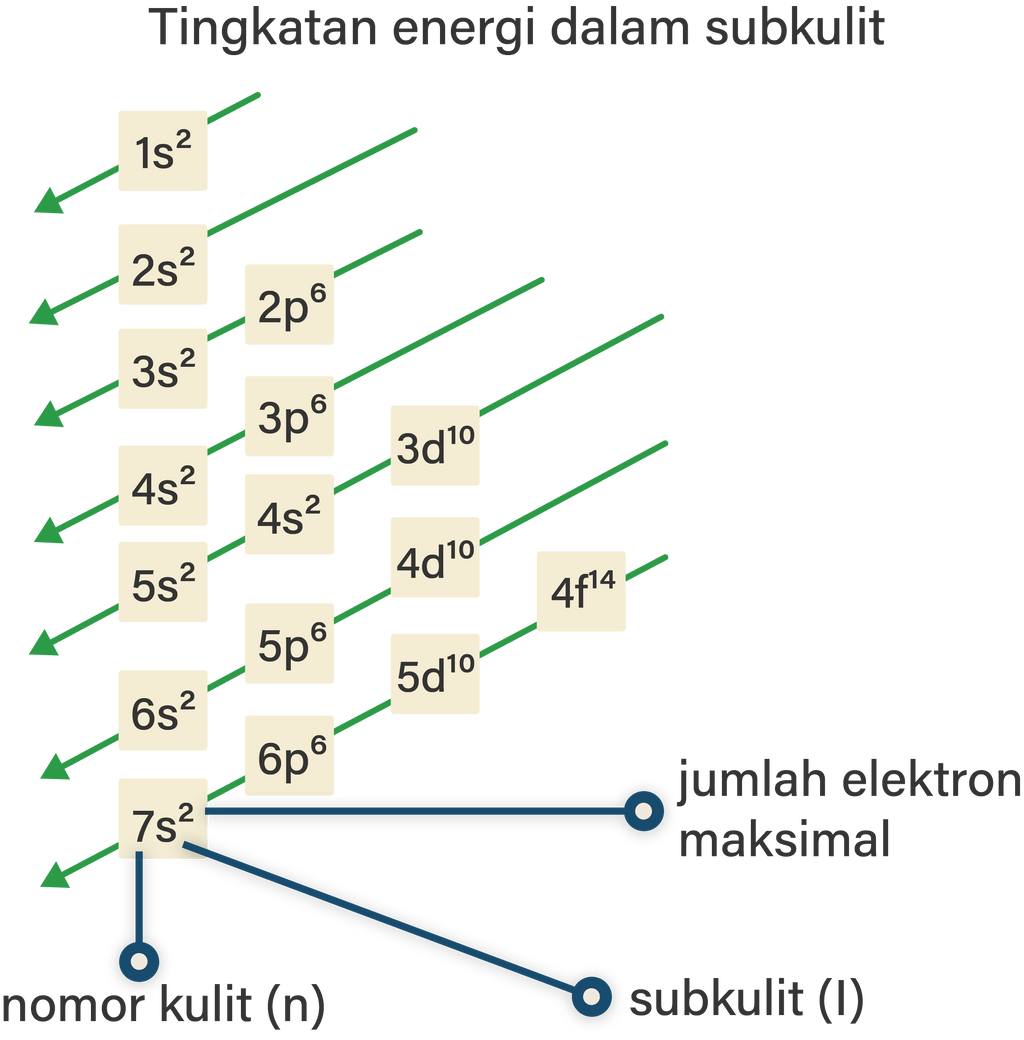
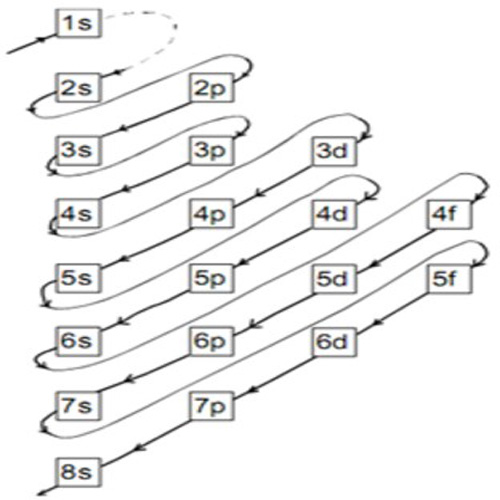
Pada gambar terlihat bahwa konfigurasi elektron dengan Prinsip Aufbau bergantung pada penjumlahan bilangan kuantum utama (n) dan bilangan kuantum azimuth (l). Urutan energi orbital atom dari yang paling rendah ke yang paling tinggi adalah 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, dan seterusnya.

Tulis dan gambarkan konfigurasi elektron dari atom atom...
Konfigurasi elektron adalah suatu susunan penyebaran (pengisian) elektron-elektron dalam . Berikut langkah konfigurasi elektron berbagai atom. Disclaimer;. Berikut ini adalah konfigurasi elektron dari unsur gas mulia. 2 He = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6; 10 Ne = 1s 2 2s 2 2p 6;

Konfigurasi elektron yang paling tepat dari unsur ₂₃V adalah YouTube
Penentuan konfigurasi elektron cara per kulit didasari oleh jumlah elektron yang dapat mengisi setiap kulit. Jumlah maksimum elektron yang dapat mengisi setiap kulit dirumuskan dengan 2n² (n= kulit yang ditempati elektron). Jumlah elektron secara maksimal yang dapat ditempati pada setiap kulit yaitu kulit pertama (kulit K) memiliki 2 elektron.

Konfigurasi elektron unsur R yang paling sesuai adalah....
Berikut adalah konfigurasi elektron unsur-unsur kelompok gas mulia sesuai dengan prinsip Aufbauf, aturan Hund, dan juga larangan Pauli! Helium (He) Helium (He) memiliki nomor atom 2, artinya helium hanya memiliki 2 elektron. Dilansir dari Chemistry LibreTexts, kedua elektron tersebut akan menduduki subkulit s dari kulit pertama yang paling.

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Tabel konfigurasi elektron. Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah hund, larangan pauli, serta hukum mekanika kuantum.

Konfigurasi elektron suatu unsur adalah 1s^2 2s^2 2p^6 3s...
Konfigurasi elektron adalah susunan elektron pada subkulit atom dalam orbital atom atau molekulnya. Pelajari Pengertian Aturan Gas Mulia Contoh Soal.. Berikut ini adalah konfigurasi elektron dari unsur gas mulia. 2 He = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6. 10 Ne = 1s 2 2s 2 2p 6.
Pengertian Konfigurasi Elektron Rumus Kimia
Pengertian Konfigurasi Elektron. Konfigurasi elektron adalah susunan elektron di dalam atom. Sejatinya, elektron merupakan partikel bermuatan negatif yang berputar mengitari inti atom.. Golongan unsur gas mulia terdiri dari He (helium), Ne (neon), Ar (argon), Kr (kripton), Xe (xenon), dan Rn (radon). Adapun konfigurasi gas mulia tersebut.

Konfigurasi Elektron
Untuk mempermudah penentuan konfigurasi elektron, gunakan Hukum Pauli, yang menyatakan bahwa elektron-elektron memiliki nilai spin, yaitu +1/2 atau -1/2. Proses penentuan konfigurasi elektron terdiri dari beberapa langkah. Langkah pertama adalah pengurutan unsur berdasarkan nomor atomnya dengan cara meningkatkan nilainya. Hal ini penting untuk.

Cara Menentukan Konfigurasi Elektron
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.
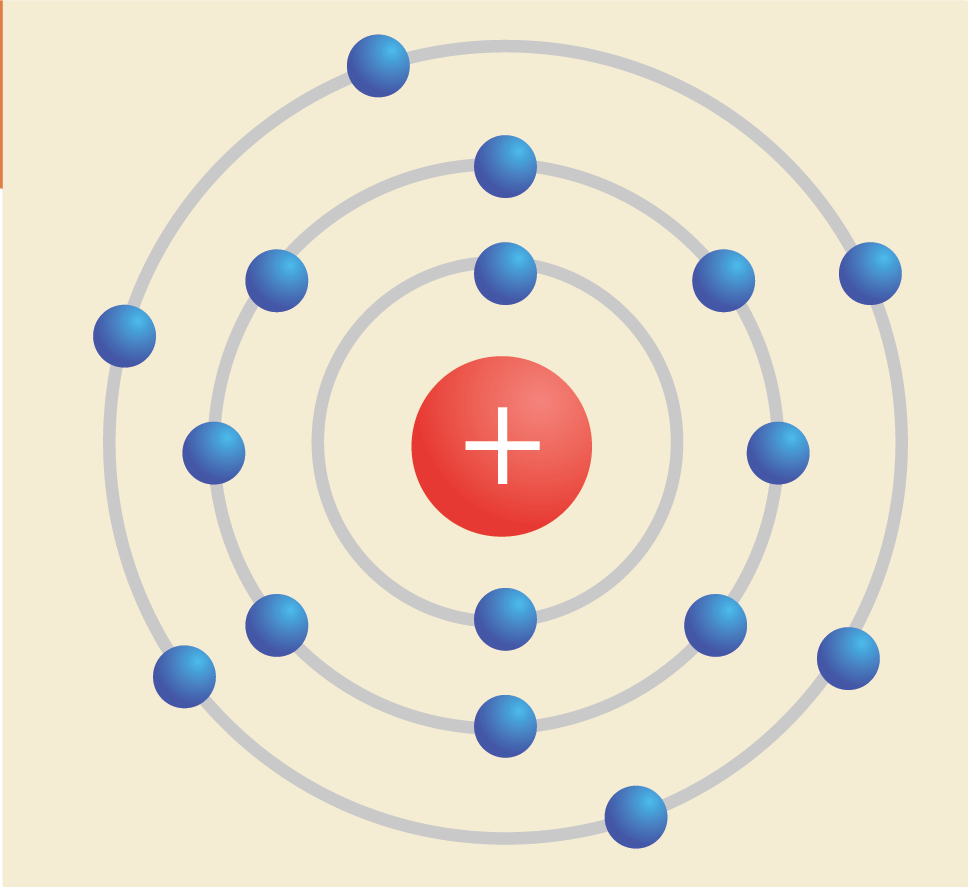
Gambar konfigurasi elektron dari unsur T ( 16 32
Menurut Bohr, jumlah elektron maksimal yang dapat menempati setiap kulit atom dapat dihitung dengan rumus 2n2. Kulit K (n = 1) maksimum 2 elektron. Kulit L (n = 2) maksimum 8 elektron. Kulit M (n = 3) maksimum 18 elektron. Kulit N (n = 4) maksimum 32 elektron, dan seterusnya. Berdasarkan konfigurasi elektron di atas, maka konfigurasi elektron.
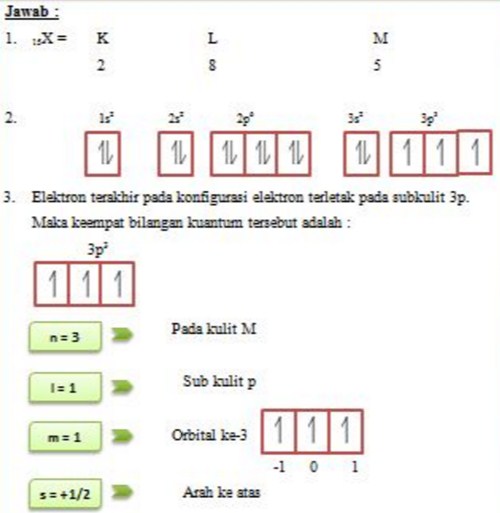
Konfigurasi Elektron Menurut Larangan Pauli Rumus Kimia
Oleh karena itu, susunan elektron valensi suatu unsur sangat mempengaruhi atau merupakan penentu sifat-sifat kimia suatu atom. Unsur-unsur yang m. Contoh Soal. Tentukan elektron valensi dari Natrium (Na)! Jawaban: Nomor atom (Z) Natrium (Na) adalah 11, maka (Na) = 2. 8. 1. Sehingga. Jumlah kulit Na = 3. Kulit terluar Na = M. Elektron valensi = 1
Konfigurasi elektron dari unsur berikut adalah...
Konfigurasi elektron. Konfigurasi elektron atom gas netral dalam keadaan dasar. Disajikan berdasarkan subkulit dalam bentuk ringkas, dengan subkulit ditulis, dan dengan jumlah elektron per kulit. Konfigurasi elektron setelah unsur nobelium (unsur 102) adalah tentatif dan setelah rutherfordium (unsur 104) adalah prediksi.

Diagram lintasan elektron unsur P dengan nomor atom = 15
Konfigurasi elektron atom-atom gas mulia dikatan stabil, karena elektron valensi pada gas mulia adalah 8 (kecuali He=2). Dilansir dari E-book Kimia SMA/MA Kelas X , kecenderungan unsur-unsur lain mencapai konfigurasi stabil gas mulia (elektron valensi 8) disebut sebagai hukum oktet, sedangkan kecenderungan mencapai konfigurasi stabil gas mulia.