
Reaksi Redoks dan Elektrokimia Kimia Kelas 12 • Part 13 Contoh Soal Hukum Faraday YouTube
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Oktober 2, 2023 Oleh Eka, S.Si. Hukum Faraday adalah ilmu yang mempelajari mengenai dasar elektromagnetisme yang merupakan proses perubahan kimia menghasilkan arus listrik maupun sebaliknya. Hukum ini dikemukakan oleh Michael Faraday, seorang ilmuwan asal Inggris yang bekerja dalam bidang elektrolisis.

HUKUM FARADAY 1 & 2Contoh soal HUKUM FARADAY UTBKSBMPTN YouTube
Berikut materi singkat Hukum Faraday 1. Materi Hukum Faraday 1 Kimia Kelas 12 SMA/MA. Hukum Faraday 1 menyatakan bahwa jumlah zat yang dihasilkan pada elektrode berbanding lurus dengan jumlah arus listrik yang melalui elektrolisis. Baca Juga: Contoh Capaian Pembelajaran Bahasa Indonesia Tingkat Lanjut Fase F SMA Kelas 11 dan Kelas 12 Kurikulum.

Contoh Soal Hukum Faraday Homecare24
Hukum Faraday: Bunyi, Rumus, & Contoh Soal. Pada tahun 1834, seorang ilmuwan bernama Michael Faraday merumuskan suatu hukum terkait hubungan antara arus listrik yang dialirkan ke dalam larutan dengan banyaknya zat kimia yang dihasilkan. Percobaan dari Michael Faraday ini kemudian menghasilkan Hukum Faraday I dan Hukum Faraday II.

48+ Soal Kimia Hukum Faraday Contoh Soal dan Jawaban
Contoh Soal Hukum Faraday. 1. Soal 1. Sumber dari gaya gerak listrik adalah.. a. magnet yang bergerak di sekitar kumparan. b. muatan listrik yang bergerak di sekitar kumparan. c. magnet yang diam di sekitar kumparan. d. dua buah magnet diam di sekitar kumparan. e. interaksi kutub-kutub magnet di sekitar kumparan.

Contoh Soal & Pembahasan Elektrolisis & Hukum Faraday Bagian II
t : Waktu (secon). F : Tetapan Faraday = 96.500 Coulomb/mol. 𝑄=𝑖×𝑡. Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram. Penyelesaian : Diketahui : W = 12 gram. Ar Ca = 40.

Kumpulan Soal Hukum Faraday Dan Pembahasannya
Menyinggung soal bunyi hukum satu ini, maka perlu diketahui bahwa hukum yang dimaksud terbagi menjadi 2, ada Faraday I dan ada Faraday 2. Penjelasan singkatnya sebagai berikut. 1. Hukum Faraday 1. Bunyi hukum Faraday 1 adalah massa zat yang dihasilkan pada elektrode selama proses elektrolisis berbading lurus dengan muatan listrik yang digunakan.

LATIHAN SOAL DAN PEMBAHASAN HUKUM FARADAY 1 (KIMIA SMA KELAS 12 ELEKTROLISIS) YouTube
Pengertian dan Bunyi hukum Faraday 1 dan 2☑️ Rumus (persamaan), Contoh Soal dan pembahasan hukum Faraday 1 dan 2 lengkap☑️ Seorang ilmuwan yang berasal dari Inggris bernama Michael Faraday menemukan sebuah hukum yang digunakan dalam ilmu kimia dinamakan Hukum Faraday. Hubungan antara penggunaan muatan listrik dan hasil massa zat dalam electrode dijelaskan melalui hukum ini.

Contoh Soal Hukum Faraday Kimia PELAJARANKU
Contoh soal hukum faraday elektrolisis nomor 3. Larutan CuSO 4 dielektrolisis selama 2 menit dengan arus 2 A. Massa tembaga (Ar Cu = 64 g/mol) yang mengendap di katode adalah. A. 79,58 g B. 15,92 g C. 7,96 g D. 79,58 mg E. 7,96 mg. Pembahasan. Pembahasan soal hukum faraday elektrolisis nomor 3. Di katode terbentuk 2e - sehingga n = 2. → e =

Contoh Soal Hukum Faraday 1 LEMBAR EDU
Contoh Soal Hukum Faraday dan Pembahasan Soal nomor 1. Fluorin dapat diperoleh dari elektrolisis leburan KHF 2, sesuai dengan reaksi berikut : HF 2 - HF + ½ F 2 + e. Hitunglah waktu yang diperlukan untuk memperoleh 26,88 liter F 2 (pada 0 o C, 1 atm) dengan arus 10 ampere! (Ar F = 19) Pembahasan :

Contoh Soal Hukum Faraday Besar Arus Listrik Akibat Perubahan Medan YouTube
Hukum Faraday dibagi menjadi dua, yaitu Hukum Faraday 1 dan 2. 1. Hukum I Faraday Hukum I Faraday berbunyi "Total zat yang dihasilkan pada elektroda, berbanding lurus dengan total muatan listrik yang. Contoh soal: Jika arus listrik dialirkan melewati larutan AgNO 3 dan larutan CuSO 4 yang disusun seri, dan terendapkan 2,16 gram (Ar Ag.

Contoh Soal Hukum Faraday 1 LEMBAR EDU
Hukum Faraday: Penerapan Dan Contoh Soal - Hukum Faraday menjelaskan tentang hubungan proses kimia dengan energi listrik. Proses ini sudah banyak dikenal diberbagai industri sebagai proses elektrolisis, yaitu proses perpindahan muatan listrik pada suatu larutan yang menghasilkan proses kimia pada larutan tersebut. Hukum Faraday ini dirumuskan dengan : W = e.F Dengan : W = massa

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 2) YouTube
Contoh Soal Hukum Faraday 1 Dan 2 1. Dalam sebuah percobaan fluks magnetik yang dihasilkan oleh medan magnetik B tegak lurus dengan permukaan seluas A adalah Ф. Apabila ukuran medan magnetik pada percobaan tersebut diperkecil menjadi ½ B dan luas permukaannya di perbesar menjadi 2 A. Jadi, berapakah fluks magnetik yang dihasilkan?.

Soal Dan Pembahasan Hukum Faraday Ruang Ilmu
Contoh Soal Hukum Faraday dan Pembahasannya.. Berikut adalah beberapa contoh soal dan pembahasannya untuk membantu kamu memahami hukum Faraday ini. Contoh 1. Hitunglah massa tembaga yang dihasilkan jika arus listrik sebesar 10 ampere dialirkan selama 9.500 detik ke dalam larutan C u SO 4 (Ar Cu= 63,5)!

Contoh Contoh Soal Hukum Faraday
Contoh soal hukum Faraday nomor 9. Sebuah kumparan terdiri atas 200 lilitan berbentuk persegi panjang dengan panjang 10 cm dan lebar 5 cm. Kumparan tersebut memiliki sumbu putar yang tegak lurus medan magnet sebesar 0,5 T dan diputar dengan kecepatan sudut 60 rad/s. GGL maksimum yang timbul pada ujung-ujung kumparan adalah.
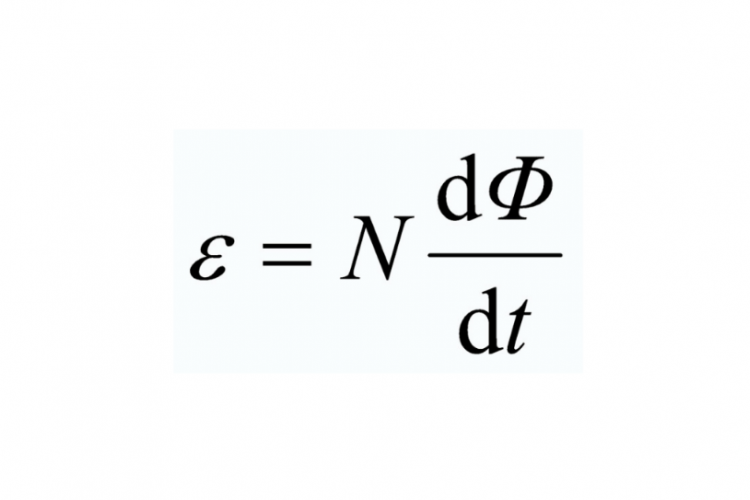
Contoh Soal Hukum Faraday I dan II Lengkap dengan Kunci Jawabannya
Bentuk latihan soal Hukum Faraday kimia kelas 12 SMA/MA ini adalah Pilihan Ganda dengan lima alternatif jawaban dan sudah tersedia kunci jawabannya yang dapat di unduh dengan mudah. Soal nomor 1 Arus listrik sebanyak 9.650 C selama beberapa waktu dialirkan melalui 1 liter larutan perak nitrat 1 M dalam sebuah sel elektrolisis.

Contoh Soal & Pembahasan Elektrolisis & Hukum Faraday Bagian II My Brain
Contoh Soal Hukum Faraday dan Pembahasan. 1. Berapa gram kalsium yang dapat dihasilkan dari elektrolisis lelehan CaCl 2 dengan elektroda grafit selama satu jam jika digunakan arus 10 A? (A r Ca = 40) Jawab: Massa Ca yang dihasilkan dapat dihitung dengan rumus: Diketahui i = 10 A; t = 1 jam = 3.600 s.